В.В.Маловичко, З.И.Уразгильдеев, А.С.Роскидайло, О.М.Бушуев, М.Б.Цыкунов
Центральный военный госпиталь ФГМУ «Медицинский центр при федеральном агентстве специального строительства».
Рост оперативной активности травматологов-ортопедов в последние 15-20 лет. Увлечение молодых врачей освоением новых методик хирургического лечения пациентов с переломами шейки бедра и костей таза с использованием погружных металлофиксаторов, в ущерб использованию ранее хорошо зарекомендовавшим себя консервативным методам и методам аппаратного лечения переломов. Расширение показаний к эндопротезированию тазобедренного сустава и внедрение этого высокотехнологичного метода, обеспечивающего при правильном его применении отличные результаты, в повседневную практику хирургов обычных травматологических отделений по всей стране привело к увеличению числа больных, страдающих послеоперационным остеомиелитом костей составляющих тазобедренный сустав.
Не уменьшается и количество пациентов страдающих посттравматическим, огнестрельным и гематогенным остеомиелитом проксимального отдела бедра и вертлужной впадины.
Лечение пациентов с данной тяжелой патологией крайне трудоемко, длительно и дорогостояще, нередко сопряжено с потерей пациентом трудоспособности, а в некоторых случаях заканчивается летальным исходом.
По данным Hanssen et al. (1996), стоимость лечения пациента без учета заработной платы врачей и среднего медицинского персонала, с гнойно-воспалительным процессом, развившимся в ранние сроки после операции эндопротезирования тазобедренного сустава, составляет 80000 долларов США, а пациента с поздним инфекционным осложнением — до 140000 долларов (7).
Таким образом, проблема хирургического купирования гнойно-воспалительного процесса, развившегося в области тазобедренного сустава с восстановлением опорной функции конечности, по сей день остается чрезвычайно сложной и актуальной (8)
Впервые хирургический метод лечения больных с гнойно-воспалительными процессами в области тазобедренного сустава был применен в Х1Х веке. В 1821г. резекционную артропластику тазобедренного сустава больному септическим артритом выполнил Antoni White. В результате операции сформировался неоартроз, который, в связи со смертью больного от чахотки, был морфологически изучен через 5 лет. После введения в хирургическую практику антисептического метода, острого долота вместо ножовки, появления рентгенографического метода резекционная артропластика тазобедренного сустава завоевала право операции выбора при огнестрельных ранениях, туберкулезных и неспецифических кокситах (15).
Внедрение в 20-х годах ХХ века гемотрансфузии, в 30-х годах — сульфаниламидных препаратов и особенно антибиотиков в конце 40-х годов, а также совершенствование методов асептики и антисептики обусловило переход операции из казуистической в разряд регулярно применяющихся вмешательств.
В 20 — 30-х годах ХХ века резекция проксимального отдела бедра с введением его в вертлужную впадину получила известность как операции Lexer-Whitmann. Метод предполагал под собой отсечение большого вертела в косом направлении с прикрепляющимися к нему мышцами. После вскрытия полости сустава осуществлялась резекция шейки бедра с удалением ее головки. Остаток шейки бедренной кости закруглялся и покрывался лоскутом жира, после чего вправлялся в вертлужную впадину. Ранее отбитый участок большого вертела крепился ниже своего основания на освеженный участок бедра с помощью шурупов. Конечность фиксировалась в тазобедренной гипсовой повязке (21, 22).
В 1924 году W.Ansch?tz сделал сообщение о 22 реконструктивных операциях, выполненных им при различных заболеваниях тазобедренного сустава (паралитические болтающиеся суставы, застарелые врожденные вывихи, болезнь Пертеса, инфекционные артриты, деформирующие артрозы, несросшиеся переломы и псевдоартрозы шейки бедра) (16).
В 1928 году GR.Girdlestone разработал и внедрил свой вариант резекционной артропластики тазобедренного сустава для лечения больных с септическим артритом и кокситом туберкулезной этиологии (20).
Суть операции состояла в создании параллельных площадок с наибольшей поверхностью соприкосновения между резецированным в косом направлении по межвертельной линии бедренной костью и частично резецированной в верхних и задних отделах вертлужной впадиной. Между этими компонентами укладываются лоскуты из рубцовой или мышечной ткани с целью создания условий для формирования неоартроза. Конечность фиксировалась в тазобедренной гипсовой повязке в течение 1 месяца.
В 1939 году P.C.Colonna опубликовал сообщение о том, что в Америке предложенная им операция была произведена 121 пациенту. Процент отличных и хороших результатов колебался в пределах 70-85% (19).
Основными моментами операции автор считал сохранение фиброзно-мышечного слоя на вершине большого вертела и пересадку абдукторов как можно ниже на диафиз бедра. В вертлужную впадину автор внедрял не культю шейки бедра, а большой вертел. Операция получила сначала название как операция Ansch?tz-Colonna, а позже как операция Colonna 2.
Обе операции, как Lexer-Whitmann, так и Ansch?tz-Colonna предполагали длительную фиксацию резецированного конца бедра, внедренного в вертлужную впадину в тазобедренной гипсовой повязке в положении отведения конечности под углом в 40-45 градусов. Через 3-5 месяцев производилась корригирующая остеотомия бедра для устранения этого порочного положения.
Впервые в истории медицины результаты лечения повреждений тазобедренного сустава на большом материале были изучены во время и после окончания Великой Отечественной войны. Так, М.О.Фридланд (1944) закруглял шейку при резекции бедра. То же самое в 1947 году рекомендовал и осуществил 4 раза с отличным функциональным результатом Б.П.Кириллов (2, 14).
Оригинальную методику обработки шейки при резекции тазобедренного сустава по поводу огнестрельных ранений предложил А.А.Полянцев (1944). Он проводил линию распила шейки под углом, сверху вниз и кнаружи (10).
В годы войны М.П.Скрынченко прооперировал 36 раненных солдат и офицеров с огнестрельными повреждениями тазобедренного сустава. Перед внедрением большого вертела в вертлужную впадину он придавал большому вертелу форму конуса. У 31 пациента был получен подвижный опорный сустав, 5 пациентов умерло (13).
В 40-х годах ХХ века появилась идея о замещении суставного конца бедра металлическим протезом. H.K.Bohlman (1939) впервые применил виталлиевый протез на ножке в виде 3-х лопастного гвоздя со сферической головкой (17). В 1952 году Moor применил металлический эндопротез с перфорированной ножкой.
В 50-60-х годах ХХ века J.Charnley разработал и внедрил в хирургическую практику эндопротез собственной конструкции с чашкой из высокомолекулярного полиэтилена для тотального эндопротезирования тазобедренного сустава с использованием костного цемента (18).
Основы тотального эндопротезирования тазобедренного сустава в нашей стране были заложены К.М.Сивашом, выступившим с докладом по данному вопросу в 1956 году.
На первом этапе освоения метода эндопротез Сиваша предназначался для лечения больных анкилозирующим спондилоартритом (болезнь Штрюмпелля-Бехтерева-Мари). Метод лечения оправдал возлагавшиеся на него надежды. Положительный опыт лечения больных привел к расширению диапазона заболеваний, при которых стали применять эндопротез Сиваша — ревматоидный артрит, деформирующий коксартроз (11).
Вместе с тем, у зарождающегося нового метода лечения больных с патологией тазобедренного сустава были и свои оппоненты. Так, Е.Т.Скляренко (1974) высказывал мнение о том, что «биологическую артропластику нельзя заменить искусственными суставами. Проблема их применения еще далека от разрешения. Искусственные тазобедренные суставы допустимы лишь в тех случаях, когда биологическая артропластика по каким-либо причинам не может быть выполнена, в основном у людей пожилого возраста» (12).
С критикой метода выступал Г. Кайзер (1974), который в своей работе отметил, что «организм стремится освободиться от любого инородного тела, в том числе и от эндопротеза, а имплантация эндопротеза с применением пластмассы (Palacos) ничего не меняет, т.к. эта пластмасса способствует отторжению эндопротеза. Тепло освобождающееся при полимеризации, повреждает кость (при температуре в 60 градусов наступает денатурация костного белка, при полимеризации же температура достигает 90 гр. и более)». У молодых людей автор предлагал выполнять по показаниям артродез тазобедренного сустава, у пожилых больных — резецировать головку и всю шейку бедра с созданием неоартроза (3).
С внедрением в широкую практику метода эндопротезирования тазобедренного сустава появилась проблема лечения гнойных осложнений.
В 1974 году К.М.Сиваш и В.Н.Гурьев на основе анализа результатов лечения 830 больных, оперированных в 1959-1973гг. в ЦИТО обозначили абсолютные противопоказания к операции эндопротезирования тазобедренного сустава: нагноительные процессы в области сустава; наличие свищей и послесвищевых рубцов; наличие свежих элементов активной туберкулезной гранулемы; наличие очага инфекции в организме больного; рубцовые изменения тканей в области тазобедренного сустава в результате ранее перенесенных операций; коксартроз, развившийся в результате перенесенного пациентом гнойного коксита; отсутствие специальной операционной, в которой проводятся только «чистые» операции, и специального отделения, в котором находятся больные после тотального эндопротезирования тазобедренного сустава (11, 1).
А.А.Покрывалов (1987) на основании проведенного статистического анализа результатов 766 эндопротезирований тазобедренного сустава, выполненных в ЦИТО с 1975 по 1983 гг. доказал, что «наиболее существенным фактором, предрасполагающим к возникновению гнойных осложнений после эндопротезирования, является наличие предшествующей эндопротезированию операции на данном суставе» (9).
Мы в ходе анализа сроков развития гнойно-воспалительного процесса у 115 эндопротезированных больных, лечившихся в ЦИТО с 1975 по 2002 гг, обнаружили следующую закономерность (5).
Из 13 больных, которым эндопротезирование было выполнено при наличии анамнестических данных о ранее перенесенном гнойно-воспалительными процессе в области заинтересованного сустава, либо сепсисе, нагноительный процесс в течение 1 года развился у 11 больных (84,6%), а в поздние сроки — у 2-х (15,4%). Средний срок развития нагноения оказался равным 5 месяцам.
Из 36 больных, которым производились те или иные операции на заинтересованном суставе, нагноительный процесс в течение 1 года развился у 24 пациентов (66,7%), в поздние сроки — у 12 больных (33,3%). Средний срок развития нагноения 1 год.
Из 66 больных, которым эндопротезирование было выполнено на интактном суставе, в течение 1 года нагноение развилось у 34 пациентов (51,5%), в поздние сроки у 32 больных (48,5%). Средний срок развития гнойно-воспалительного процесса оказался равным 2 годам 8 месяцам.
То есть, наибольший риск, в плане развития гнойных осложнений, был связан с эндопротезированием тазобедренного сустава больным, в анамнезе которых отмечался тот или иной гнойно-воспалительный процесс или у которых имелись послеоперационные рубцы в области сустава.
Другими словами, проведенный анализ подтвердил известный тезис классиков метода о необходимости дифференцированного подхода к отбору пациентов, которым показано выполнение эндопротезирования тазобедренного сустава с благоприятным отдаленным результатом.
В настоящее время помимо специализированных центров по эндопротезированию крупных суставов с обученным персоналом, высококвалифицированными хирургами, соблюдающими строгий отбор больных, оперирующими в операционных с ламинарным потоком воздуха с минимальной кровопотерей и в кратчайший временной промежуток, метод стал широко внедряться в практику работы травматологических отделений обычных городских больниц по всей стране.
По данным разных авторов, ежегодно в мире выполняется от 1 до 1,5 миллионов тотальных замещений тазобедренного сустава. В России в начале 90-х выполнялось 3200 подобных операций в год, в то время как ориентировочная ежегодная минимальная потребность в эндопротезах по РФ составляет 20-25 тысяч, а максимальная 100 тысяч (4).
Многие хирурги при принятии решения о необходимости эндопротезирования тазобедренного сустава все чаще игнорируют наличие хронического гнойно-воспалительного процесса в области тазобедренного сустава у пациента или латентного очага инфекции в организме, не говоря уже о наличии рубцово-измененных тканей после ранее перенесенных реконструктивных операций на тазобедренном суставе. По данным разных авторов, процент гнойных осложнений после эндопротезирования колеблется в пределах от 0,2 до 58,5%. (5).
Основными методами лечения гнойно-воспалительных процессов в области тазобедренного сустава в настоящее время является одно или двухэтапное эндопротезирование сустава либо его артродезирование с использованием различных металлофиксаторов или тазобедренной гипсовой повязки (8, 6).
Соглашаясь с мнением родоначальников метода эндопротезирования о нецелесообразности его использования в лечении больных с гнойно-воспалительными процессами и опираясь на наш многолетний опыт лечения больных с этой тяжелой патологией, считаем что проведение эндопротезирования тазобедренного сустава больным с гнойно-воспалительными процессом крайне опасно из-за высокого риска развития как ранних, так и поздних послеоперационных гнойных осложнений.
Проведение операций по артродезированию тазобедренного сустава больным с гнойно-воспалительным процессом с использованием как погружных, так и внешних фиксаторов, включая тазобедренную гипсовую повязку, мы считаем также неправильным. С нашей точки зрения, артродезирование сустава при данной патологии чревато развитием нагноительного процесса в области фиксатора с возникновением необходимости его раннего удаления и остающейся нерешенной проблемой купирования гнойно-воспалительного процесса, но в худших условиях, чем до выполнения артродеза, во-первых. Во-вторых, в случае достижения анкилоза очень высок риск развития рецидивов остеомиелитического процесса с появлением необходимости проведения в последующем многократных фистулсеквестрнекрэктомий. В-третьих, даже при отсутствии инфицирования и дестабилизации тех или иных фиксаторов высоким остается риск развития несостоятельности артродеза на фоне некупированного гнойно-воспалительного процесса с необходимостью выполнения повторных оперативных вмешательств.
Адекватной альтернативой, как эндопротезированию, так и артродезированию тазобедренного сустава при гнойно-воспалительных процессах, по нашему мнению, является выполнение резекционной фистулсеквестрнекркэтомии проксимального отдела бедра и вертлужной впадины с созданием опорного неоартроза, что позволяет, как купировать нагноительный процесс, так и добиться хорошего функционального результата для больного.
С 1985 по 2005 год нами на базе отделения «гнойных осложнений и последствий травм опорно-двигательной системы» ЦИТО и отделения «гнойной хирургии» ЦВГ при «Спецстрое России» прооперировано 75 больных с гнойно-воспалительными процессами в области тазобедренного сустава (хронический и острый послеоперационный, посттравматический, гематогенный, огнестрельный остеомиелиты) в возрасте от 9 до 75 лет. У всех больных удалось купировать нагноительный процесс и добиться формирования опорного неоартроза с восстановлением опорной функции конечности практически в полном объеме.
С целью улучшения результатов лечения больных с данной патологией нами разработан и внедрен комплекс лечебно-реабилитационных мероприятий направленный на купирование нагноительного процесса с формированием опорного неоартроза в суставе и восстановлением опорной функции конечности.
Комплекс лечебно-реабилитационных мероприятий, направленный на купирование гнойно-воспалительного процесса.
- Радикальная санация местного патологического очага путем удаления всех некротизированных тканей, иссечение свищевых ходов на всем протяжении, секвестрнекрэктомия остеомиелитически измененных участков костной ткани.
- Налаживание адекватного ирригационно-вакуумного дренирования послеоперационной раны с длительным ее промыванием растворами антисептиков.
- Адекватная антибактериальная терапия: начало проведения антибактериальной терапии за 2 часа до операции препаратами широкого спектра действия с последующей их корректировкой на 1 -2 день после операции на основании данных посева операционного материала, полученных как в аэробных, так и анаэробных условиях, а затем на основании данных посевов отделяемого из дренажей.
- Коррекция гомеостаза, иммунокоррекция.
- Программа функционального лечения больных с целью создания опорного неоартроза, которая состоит из 3-х этапов (приводится ниже).
- Профилактика рецидива.
Операция производится в положении больного на здоровом боку из наружне-бокового доступа. Следует отметить, что при наличии функционирующего свища необходимо выполнять тугое заполнение свищевого хода 2% спиртовым раствором бриллиантового зеленого, после чего производится разрез с иссечением послеоперационного рубца и свищевого хода на всем его протяжении. При наличии инфицированных металлоконструкций производится их удаление, а затем выполняется резекционная секвестрнекрэктомия проксимального конца бедренной кости и вертлужной впадины с иссечением всех окрашенных бриллиантовым зеленым и вызывающих сомнение в плане жизнеспособности тканей. При бессвищевой форме остеомиелита выполняется резекционная секвестрнекрэктомия проксимального отдела бедра и вертлужной впадины в пределах здоровой (кровоточащей) костной ткани. С помощью рашпиля и электрической дрели зачищается резецированный участок бедренной кости и удаляются все острые костные выступы и на вершине санированного проксимального конца бедренной кости в сагиттальном направлении выпиливается овальная неглубокая выемка.
Выемка обеспечивает более стабильный контакт бедренной кости и вертлужной впадины. Затем раневая полость обильно промывается растворами перекиси водорода и хлоргекседина, после чего тщательно вакуумируется с помощью отсоса. Больной переводится в горизонтальное положение, оперируемая конечность отводится до угла в 40-45 градусов и укладывается на дополнительный стерильный операционный стол с фиксацией стопы в нейтральной позиции в деротационном сапожке. Рана дренируется двумя дренажами. Однополюсной дренаж подводится к вертлужной впадине, а 2-х полюсной проводится в продольном направлении по длине всей раны под мышцами, после чего рана послойно плотно ушивается наглухо. После завершения операции больной переводится в палату без изменения заданного угла отведения со стопой фиксированной в деротационном сапожке. Такая фиксация, наряду с активным функциональным лечением в послеоперационном периоде, обеспечивает управляемый процесс формирования опорного неоартроза. С первого дня после операции начинается проведение комплексной программы реабилитации. За счет тяги околосуставных мышц проксимальный конец бедренной кости постепенно приближается к крыше вертлужной впадины. Эти костные структуры начинают контактировать и артикулировать, сформированная во время операции выемка создает условия для большей стабильности, одновременно формируются рубцы, которые удерживают проксимальный конец бедра у крыши вертлужной впадины. Временной промежуток с необходимостью постельного режима в среднем составляет 3-4 недели и напрямую связан с формированием рубцовой ткани в области формирующегося неоартроза. Основным показателем формирования достаточно крепкой рубцовой ткани является свободное удержание больным освобожденной из деротационного сапожка стопы в функционально правильной нейтральной позиции в течение суток. На этом этапе больной начинает обучаться сидению в постели и стоянию в палате на костылях с отведенной под угол в 20 градусов ногой с использованием обуви с набойкой на подошве для компенсирования анатомически функционального укорочения.
Программа функционального лечения больных с целью создания опорного неоартроза.
- А. Ранний послеоперационный период (постельный режим до 30 дня после операции). 1-А. Ранний послеоперационный период — до 10 дня после операции. 2-А. Ранний послеоперационный период — с 10 по 20 день после операции. 3-А. Ранний послеоперационный период — с 20 по 30 день после операции.
- Б. Поздний послеоперационный период (с 30 дня и до выписки больного из стационара).
- В. Период реабилитации в амбулаторных условиях (до 6-8 месяцев после выписки больного из стационара).
Суть этих реабилитационных мероприятий состоит в том, что лечебная гимнастика для мышц оперированной конечности и туловища начинается с раннего послеоперационного периода в постельном положении с минимального числа упражнений и проводится в возрастающем темпе с течением времени.
Ранний послеоперационный период 1-А — до 10 дня после операции:
в горизонтальном положении отведения конечности под 45 градусов, со стопой фиксированной в нейтральном положении деротационной шиной до 5-10 минут 3 раза в день проводятся: изометрические упражнения для мышц оперированной и здоровой нижней конечности; щадящие пассивно активные сгибания в коленном суставе; присаживание в постели с использованием Балканской рамы; занятия для укрепления мышц рук и здоровой ноги с использованием резинового бинта или эспандера. На 5-7 день добавляются упражнения по активной попытке отрыва выпрямленной ноги от плоскости постели.
Ранний послеоперационный период 2-А — с 10 по 20 день после операции: на фоне продолжающихся упражнений, больной обучается свободному сидению в постели со спущенной здоровой ногой, и продолжительность занятий увеличивается до 10-15 минут 3 раза в день. В комплекс добавляются упражнения по разгибанию туловища с отрывом таза от плоскости постели до 50-100 раз в сутки.
Ранний послеоперационный период 3-А — с 20 по 30 день после операции:
продолжительность проведения занятий гимнастикой увеличивается до 15-20 минут 3 раза в день. Добавляют упражнения по активному сгибанию ноги в коленном суставе с попытками отрывать разогнутую оперированную ногу от постели до 100 раз в день. К 25 дню на некоторое время стопа вынимается из деротационного сапожка и фиксируется между валиками с песком.
Б. Поздний послеоперационный период — с 30 дня до выписки больного из стационара: продолжительность занятий увеличивается до 20-30 минут 3 раза в день. Активные сгибания ноги в коленном суставе с попытками ее отрыва от постели увеличивают до 200 раз в день. Больного обучают стоянию и ходьбе на костылях с отведенной конечностью под угол в 20-30 градусов в обуви с набойкой для компенсации укорочения до 5 минут 3 раза в день. Добавляют упражнения по сгибанию и отведения ноги из положения стоя и самостоятельному присаживанию на стул с регулируемой высотой сидения (подкладываются подушки) до 10-15 упражнений 3 раза в день.
В. Период реабилитации больного в амбулаторных условиях: на фоне продолжающегося реабилитационного комплекса из положения лежа и стоя до 45 минут 3 раза в день количество всех упражнений увеличивают до 100 в день. Больной ходит на отведенной конечности до 30 минут в день с нагрузкой на ногу до 10-15% от нормы с ежемесячным увеличением нагрузки еще на 10-15% а продолжительности ходьбы на 30 минут. С момента (в среднем 3-4 месяца после операции), когда пациент может свободно оторвать ногу от плоскости постели и удержать ее в таком положении некоторое время нога может быть приведена в функционально правильное положение с соответствующим уменьшением высоты набойки для компенсации анатомического укорочения. Больной постепенно переходит на ходьбу с одним костылем или тростью. В тот день, когда пациент встанет и забудет о необходимости взять в руки костыль или трость (в среднем 4-6 месяцев) он сможет постепенно переходить на ходьбу без дополнительной опоры.
ВЫВОДЫ:
Разработанный и внедренный нами метод по формированию опорного неоартроза качественно отличается от методов резекционной артропластики Lexer-Whitmann, Anschutz-Colonna и GR.Girdlestone, так как, во-первых, позволяет добиться купирования остеомиелитического процесса у больных, как правило, с запущенными, тяжело протекающими формами остеомиелита. Во-вторых, не требует длительной дополнительной фиксации оперированной конечности в тазобедренной гипсовой повязке, а напротив подразумевает под собой проведение активной реабилитационной программы, направленной на восстановление функции сустава. В-третьих, для формирования опорного неоартроза не требуется использования пластических материалов (жировой, мышечной и других видов ткани), так как в ходе лечения резецированные костные фрагменты закрываются собственной соединительной тканью. В-четвертых, при удачном исходе лечения по предложенному нами методу больной избавляется от воспалительного процесса, от болей в суставе, практически полностью восстанавливает опорную и двигательную функцию сустава и полностью избавляется от необходимости повторных оперативных вмешательств.
КЛИНИЧЕСКИЙ ПРИМЕР.
Больной С. 16 лет. Диагноз — острый гематогенный остеомиелит головки левого бедра, свищевая форма. В одной из клиник г. Москвы был проведен курс консервативного лечения антибиотиками, предпринята попытка артродезирования сустава в тазобедренной гипсовой повязке. Консервативное лечение эффекта не дало. Больной был госпитализирован в 5 отд. ЦИТО и оперирован (Рис 1 — фистулограмма; Рис 2 — компьютерная томограмма; Рис 3 — секвестрировавшаяся, прокрасившаяся бриллиантовым зеленым головка бедра).
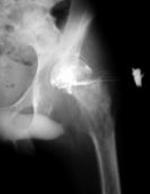 Рис 1 Рис 1 | 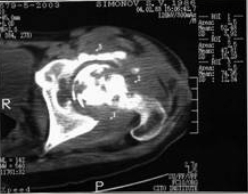 Рис 2 Рис 2 | 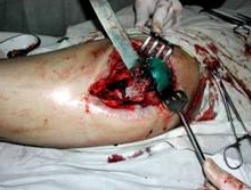 Рис 3 Рис 3 |
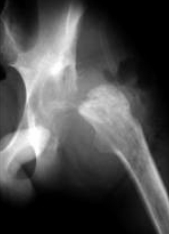 Рис 4 Рис 4 |  Рис 5 Рис 5 |  Рис 6 Рис 6 |  Рис 7 Рис 7 |
Воспалительный процесс купирован, сформирован опорный неоартроз (рис 4 – рентгенограмма формирующегося неоартроза после операции, видны дренажи; Рис 5, 6, 7 – функциональный результат через 6 месяцев, укорочение конечности на 6 см.).
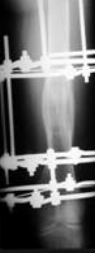 Рис 8 Рис 8 |  Рис 9 Рис 9 | 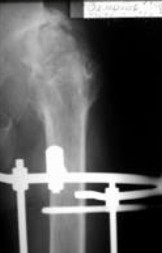 Рис 10 Рис 10 | 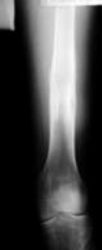 Рис 11 Рис 11 | 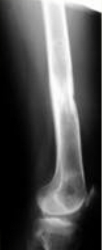 Рис 12 Рис 12 |
Аппарат демонтирован через 10 месяцев после начала удлинения бедра. Опорная функция неоартроза восстановлена полностью через 1 месяц (Рис 13, 14, 15, 16 – функциональный результат после снятия аппарата Илизарова, длина конечности полностью восстановлена; Рис 17 – неоартроз через 2 года после операции).
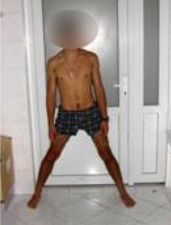 Рис 13 Рис 13 | 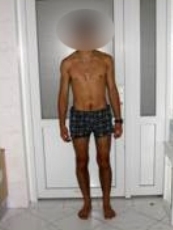 Рис 14 Рис 14 |  Рис 15 Рис 15 |  Рис 16 Рис 16 | 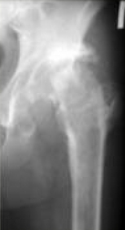 Рис 17 Рис 17 |
 |

